UNIST 이현우 교수‧서울대 김종서 교수 연구팀 공동

[한국대학신문 김정현 기자] 인간 세포의 에너지 공장인 미토콘드리아의 기능을 담당하는 막단백질 구조를 밝히는 새로운 원천기술이 국내 연구팀에 의해 개발됐다. 미토콘드리아 내막단백질 이상은 대사 관련 질병은 물론 암, 당뇨, 노화 등과 연결된다. 미토콘드리아를 겨냥한 신약 개발에 전기가 될 것으로 기대된다.
울산과학기술원(UNIST, 총장 정무영)은 10일 이 대학 이현우 교수(화학) 연구팀 이송이 연구원(석‧박통합)이 김종서 서울대 기초과학연구원 RNA연구단 교수팀과 공동으로 미토콘드리아 막단백질에 특정 화학물질을 붙여 구조를 이해할 수 있는 신기술을 개발했다고 밝혔다.
미토콘드리아는 신체의 에너지 공장이다. 에너지를 사용해 일을 하는 세포는 모두 미토콘드리아를 소기관으로 갖고 있다. 미토콘드리아는 가장 안쪽에 기질을 갖고 있으며 이를 둘러싸는 두 개의 막(외막, 내막)으로 구성된다. 이를 ‘이중막 구조’라 부르며, 미토콘드리아의 특징 중 하나다.
미토콘드리아 내막에 위치한 내막 단백질은 다양한 중요 기능을 수행한다. 인간이 섭취하는 식품은 소화과정을 거쳐 포도당으로 분해돼 에너지가 필요한 각 세포로 보내진다. 미토콘드리아는 포도당을 받아 세포가 활용할 수 있는 에너지 물질 ATP로 환전한다. 이 때 미토콘드리아 내막을 관통하거나 부착된 내막 단백질들이 핵심적 역할을 한다. 내막 단백질들은 대사 외에도 미토콘드리아 생성, 이온‧영양분과 같은 물질 수송, 신호전달 및 세포 간 커뮤니케이션 등 필수적 작용에 관여한다. 때문에 연구팀은 자료에서 “시중에 판매 중인 약 절반 정도가 막 단백질을 표적으로 하고 있다”고 강조한다.
미토콘드리아 내막 단백질의 구조를 규명함으로써 대사 질병의 원인을 규명하고, 표적 약물을 만들어 낼 수 있다. 단백질은 생체의 기능 단위로, 다종‧다양한 아미노산들이 특정한 순서대로 배열돼 고유한 기능, 특징을 갖게 된다. 아미노산이 하나만 잘못돼도 때론 심각한 질병이 발생할 수 있다. 미토콘드리아 내막 단백질은 다양한 기능을 수행하는 만큼 복잡하다. 단백질끼리 모여 거대 복합체를 이루는 일이 많다. 미시적인 수준에서 단백질의 구조를 명확히 밝히는 기술이 필요한 이유다.
단백질 구조를 밝히기 위해서는 특수한 화학적 처리가 필요하다. 질량 분석기가 단백질을 인식하도록 하는 표지 물질로 바이오틴-페놀(Biotin-phenol)이 주로 쓰인다. 이 물질은 단백질이 갖는 아미노산 타이로신(Tyrosin)에 특이적으로 부착한다. 본래 두 물질은 각각 안정하여 쉽게 붙지 않는다. 탐지를 위해선 과산화효소를 이용한 산화-환원 반응을 거쳐야 한다. 페놀 물질을 과산화효소로 처리하면 수소 원자 하나를 잃은 페놀라디칼이 된다. 극도로 불안정하지만 그만큼 안정한 아미노산에 쉽게 붙는다. 이를 통해 단백질의 질량이 늘어난 위치를 검정, 늘어난 부위가 내막 안쪽(기질)에 있는지, 밖(막간공간)에 있는지 ‘방향성’을 규명한다.
기존 연구에서는 과산화효소로 고추냉이에서 추출한 HRP(Horseradish peroxidase)를 활용했다. 그러나 이 물질은 산화-환원 과정에서 핵심 구조가 쉽게 분해돼 생체 내에서 단백질을 판별하기 어려웠다. 때문에 미토콘드리아를 따로 빼내거나, 단백질 결정으로 분해하여 각각 분석하는 방법을 이용했다. 또 바이오틴-페놀이 처리 과정에서 원치 않는 부위(황)까지 산화되면서 동정 과정에서 정확성도 떨어졌다. 대량으로 신속하게 실험할 수 없어 비용 면에서도 많은 소요를 낳았다.
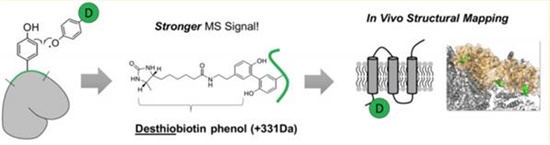
연구팀의 이번 성과는 살아있는 세포 내에서 내막 단백질들의 방향성을 규명할 수 있는 세계 최초의 기술이다. 2012년 미국 매사추세츠공과대(MIT)서 개발된 에이펙스(APEX) 덕택이다. 이 물질은 대두에서 추출한 과산화효소다. 산화-환원 반응에도 세포 내 어느 공간에서나 활성을 유지하고 페놀라디칼을 생성한다. 연구팀은 인간 배아 신장 세포(T-REX HEK293)에 APEX 유전자를 주입, 단백질을 발현시켰다. 살아있는 세포에서 미토콘드리아 내막 단백질 방향성을 분석할 수 있게 된 것이다.
연구팀은 이 기술을 활용해 기존에 알려졌던 내막단백질 구조를 확인 및 바로잡거나, 새로 발견해 총 135개 단백질 구조를 밝혀 논문에 실었다. 또 바이오틴-페놀에서 황을 제거한 디싸이오바이오틴-페놀(Desthiobiotin-phenol)을 활용함으로써 정확성, 효율을 늘렸다. 이 물질은 질량 분석기로 단백질을 끌어오기 위해 쓰는 물질 ‘스트렙타비딘’과 결합력이 약하다. 회수‧분석할 수 있는 단백질 총량이 늘어난다는 설명이다.
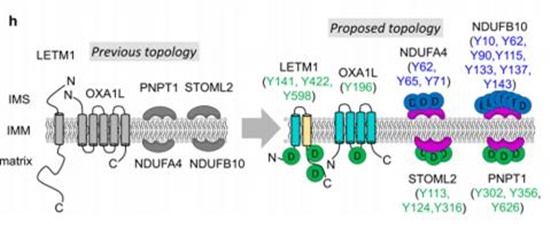
연구책임자 이현우 UNIST 교수는 “미토콘드리아 막 단백질 복합체의 구조를 이해하는 일은 미토콘드리아를 겨냥한 새로운 치료법을 개발하는 데 있어서 아주 중요하다”며 “새로운 페놀 화합물을 이용해 막 단백질의 구조를 파악하는 기술은 다른 막 단백질을 표적으로 하는 신약 개발에도 도움을 줄 것”이라고 전망했다.
한편 이번 연구는 보건복지부와 한국보건산업진흥원의 질환극복기술개발(세계선도 의생명과학자 육성) 사업과 서울대 기초과학연구원의 지원으로 수행됐다. 화학 분야의 국제 학술지 미국화학회지(JACS, Journal of the American Chemical Society)에 지난 3월 15일자로 게재됐다.












































































