서울대 강찬희∙김진홍 교수 연구진, 콜레스테롤의 조절과 작용 원리 규명
[한국대학신문 이정환 기자] 체내의 높은 콜레스테롤 수치는 심장병을 비롯한 다양한 심혈관계 질환을 통해 건강에 악영향을 끼친다. 수많은 역학 조사를 통해 이러한 콜레스테롤의 이상이 노화 및 다양한 노화 연관 질환에서도 관찰됨이 잘 알려졌으나, 그 인과관계는 여전히 수수께끼로 남아있었다.

최근 국내 연구진이 콜레스테롤의 노화 유도 기전을 새롭게 밝혀내, 이러한 난제 해결에 중요한 실마리를 제공했다. 서울대학교 생명과학부 강찬희∙김진홍 교수가 이끄는 공동 연구진은 3일 세포 노화 및 노화 연관 염증 반응을 일으키는 콜레스테롤의 조절과 작용 원리를 알아냈다고 밝혔다.
세포 노화(cellular senescence)는 정상세포가 스트레스를 받아 분열을 영구히 멈추고, 다양한 염증 인자를 분비하는 현상이다. 최근 노화 세포의 축적이 암, 심혈관계 질환, 퇴행성 질환 등 여러 노화 연관 질환의 주원인으로 작용함이 알려지면서, 노화 세포 표적 기술(senotherapy: 세노테라피)이 차세대 노화 치료제 후보로 세계적인 주목을 받고 있다. 이는 2022년 미국국립보건원(NIH)의 대규모 연구 프로젝트 ‘세포 노화 네트워크(SenNet, $125 million 규모)’ 발족과 제프 베조스(Jeff Bezos) 아마존 창업자의 세포 노화 기반 치료제 개발 회사 알토스랩스(Altos Labs)에 대한 대규모 투자에서 쉽게 알 수 있다. 이처럼 노화 세포의 표적이 ‘인류의 노화에 대한 전쟁’에 있어서 승리의 실마리로 주목받고 있지만, 기술의 상용화를 위해서는 노화 세포의 특성에 대한 심도 있는 이해와 제어법 규명이 필요한 상황이다.
연구진은 이를 위해 노화 세포가 분열하지 않는 세포임에도 불구하고 높은 영양-에너지 대사 경로의 활성을 유지하고 있다는 데 주목했다. 연구진은 이러한 노화 세포의 특성이 세포 내 ‘분해 공장’으로 알려진 리소좀에 특이하게 축적되는 콜레스테롤에 의해 조절됨을 새롭게 규명하고, 해당 경로의 억제 시 노화 세포로부터 분비되는 해로운 염증 유발 인자의 생산을 크게 저해할 수 있음을 확인했다.
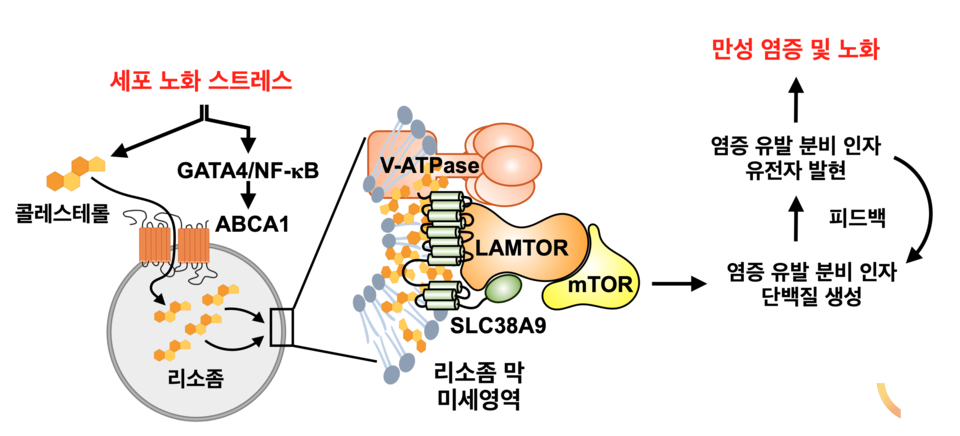
연구진은 독자적으로 개발한 ‘초고속 리소좀 분석 기술’을 활용해 노화 세포의 리소좀 내 콜레스테롤 축적 기전의 핵심 인자 ABCA1 또한 동정했다. 이렇게 축적된 콜레스테롤은 리소좀의 특이적 구조 변화를 일으켜, 영양-에너지 대사 경로 조절 인자의 상호 결합을 촉진하고 비정상적 활성화를 유도한다. 연구진은 마지막으로 ABCA1의 활성 제어를 통한 노화 연관 염증 인자의 생산 조절이 대표적인 노화 연관 질환인 퇴행성관절염의 증상 완화에 크게 기여할 수 있음을 검증했다.
강찬희 교수는 “이번 연구 결과는 오랫동안 베일에 싸여있던 콜레스테롤의 노화 유발 기전을 세포 노화 조절을 통해 규명했다는 데 의의가 있으며, 이를 활용해 효율적인 노화 세포 표적 전략 수립에 힘쓸 것이다”라며 “리소좀 특이적 콜레스테롤의 축적은 영양-에너지 대사 경로의 이상 조절이 잘 보고된 암세포에서도 일어날 수 있다”라고 밝혔다.
연구의 공동 교신저자인 김진홍 서울대 생명과학부 교수는 “리소좀 특이적 ABCA1의 활성 억제제는 노화 연관 염증 반응에 의해 발생하는 퇴행성관절염의 효과적인 치료제로 적용될 수 있다”라며 “해당 억제제는 노화의 기본 단위인 세포 노화를 표적하기에, 더욱 광범위한 노화 연관 질환의 치료제로 개발될 가능성 또한 높다”라고 말했다.
서울대 생명과학부 강찬희 교수 연구진이 서울대 생명과학부 김진홍∙정종경 교수 연구진 그리고 순천대 백만정 교수 연구진과 협업해 수행한 이번 연구는 서경배과학재단, 한국연구재단, 그리고 삼성미래육성재단의 지원을 받았으며, 대사 분야 최고 국제학술지 〈네이처 메타볼리즘(Nature Metabolism)〉에 3일 공개됐다.












































































