한양대 생명과학과 김철근 명예교수 연구팀
향후 암 관련 신약 개발의 단초 제공할 것으로 기대
[한국대학신문 이정환 기자] 한양대학교 생명과학과 김철근 명예교수 연구팀이 정상세포에는 부작용 없으면서 모든 종류의 암세포를 제어할 수 있는 탁월한 항암제 개발 가능성을 제시했다고 한양대가 20일 밝혔다.

암은 치료법의 혁신과 다양한 항암제의 개발에도 불구하고 전 세계적으로 대표적인 사망원인 중 하나이다. 암의 발생 원인이 환자마다 다양하고 항암 치료 이후에도 일부 살아남은 암세포(예, 암줄기세포)들로 인해 빈번하게 암이 재발하거나 다른 기관으로 퍼지는 암 전이 현상 때문이다.
특히 전이암의 경우 항암제에 대한 강한 내성을 보여 암 환자 사망원인의 90% 이상을 차지하고 있다. 또한 우수한 항암제일지라도 암의 종류에 따라 환자군의 15~40%만이 반응을 보이며, 정상세포에 심각한 부작용을 나타내기도 한다. 따라서 이상적인 항암제는 정상세포에 부작용을 나타내지 않고 암세포만을 제어하며, 특히 암줄기세포까지 표적하여 암의 재발, 전이 및 항암제 내성까지 제어할 수 있어야 한다.
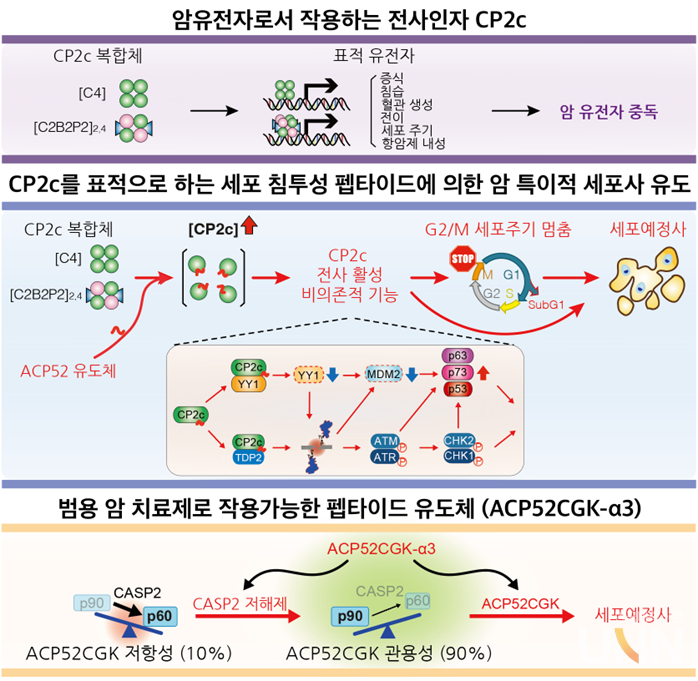
암세포는 암의 증식과 유지를 위해 필수적인 세포 내 경로를 보유하고 있으므로, 이와 관련한 특정 암유전자에 중독현상을 나타낸다. 김 교수팀은 암 유전자 중독현상을 유발하는 전사조절인자(전사인자 및 후성조절인자)는 우수한 항암제 개발 표적이 될 수 있음에 착안해 암유전자로 작용하는 전사인자 CP2c에 대해 연구해 왔다.
전사인자 CP2c는 다양한 암종에서 높은 발현을 보이는 반면, 정상세포에서는 낮은 발현을 보인다. 대부분의 암 세포에서 CP2c 단백질은 높은 농도로 유지되며 암 특성을 나타내는 유전자 발현을 조절한다. 이로 인해 암세포는 CP2c 발현에 의존하는 중독 현상을 나타내며, 이때 CP2c 단백질 발현 정도는 종양의 악성화와 비례해 나타난다고 알려지고 있다.
이러한 CP2c의 특성을 바탕으로 김 교수팀은 CP2c 단백질 복합체에 결합해 작용하는 항암 펩티드(ACP52C)를 개발했다. 연구팀이 개발한 항암 펩티드는 암 유발 돌연변이나 약제 내성과 무관하게 암세포 특이적인 세포사를 유도했으며, 실제 환자(간암 및 유방암) 유래 세포의 85% 이상에서 세포사를 유도했다.
김 교수팀은 개발한 항암 펩티드가 어떠한 기전을 통해 이러한 이상적인 항암효과를 나타내는지 또한 밝혀냈기 때문에 향후 암 예방제나 암 예후관리제와 같은 신약 개발에도 큰 단초를 제공할 수 있을 것으로 기대된다.
김 교수는 “개발된 항암제는 구토, 탈모와 같은 전신적 부작용이나 항암제 내성 발현과 같은 한계를 지닌 기존의 치료법들과는 달리 정상세포에 해를 주지 않으면서 완치를 기대할 수 있는 신개념 펩티드 기반의 암 치료제” 라며 “임상시험 후 상용화에 성공한다면 많은 난치성 암 환자들에게 희망을 줄 것”이라고 전망했다.
한편, 김 교수팀은 본 개발 관련 4건의 원천 지적재산권을 국내·외 특허 출원 및 등록했으며, 김철근 교수가 2020년 설립한 CGK Biopharma (대표이사 김철근 한양대 명예교수)에서는 이러한 원천기술을 바탕으로 비임상 및 임상시험을 진행하고 있다.
한국연구재단 중견연구자지원사업과 과학기술정보통신부 바이오·의료기술개발사업의 지원을 받아 수행된 이번 연구는 〈Advanced Science〉에 10월 17일 게재됐다. 해당논문은 손승한, 김민영, 최성우 한양대 박사과정 학생들이 제1저자로 참여하고, 33명의 국내외 연구자들이 공동저자로 참여했다.












































































