의약화학분야 최고 권위지에 결핵균 단백질 기반 새 치료전략 연구결과 게재
[한국대학신문 문화춘 기자] 건국대학교 김양미 교수(시스템생명공학과) 연구팀이 결핵균 단백질을 기반으로 한 새로운 방식의 항균 펩타이드를 개발했다. 이번 연구 성과는 기존 항생제로는 치료가 어려운 다제내성 그람음성균에 대한 차세대 치료제 후보로 주목받고 있으며, 연구 결과는 의약화학 분야 최고 권위지인 〈Journal of Medicinal Chemistry〉에 지난 4일 온라인 게재됐다.

연구팀은 결핵균의 아데닐레이트 키네이스(adenylate kinase) 단백질이 그람음성균 내독소(LPS)와 결합하는 특성을 발견했다. 이에, 핵자기공명분광법(NMR) 분석을 통해 이 단백질의 모노포스페이트(AMP) 결합 부위가 LPS 결합 부위임을 규명하고, 이를 바탕으로 단 11개 아미노산으로 구성된 항균 펩타이드를 설계했다. 그중 ‘67(YK-mAK-15)’이라 명명된 펩타이드는 강력한 항균력과 낮은 독성을 동시에 보여 가장 유망한 후보물질로 평가됐다.
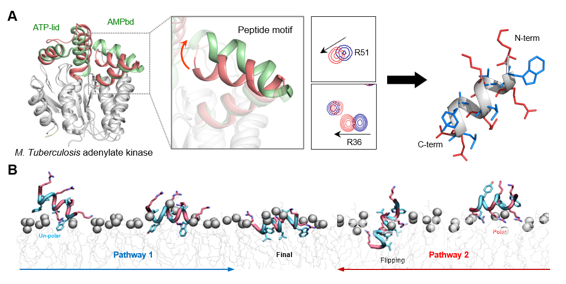
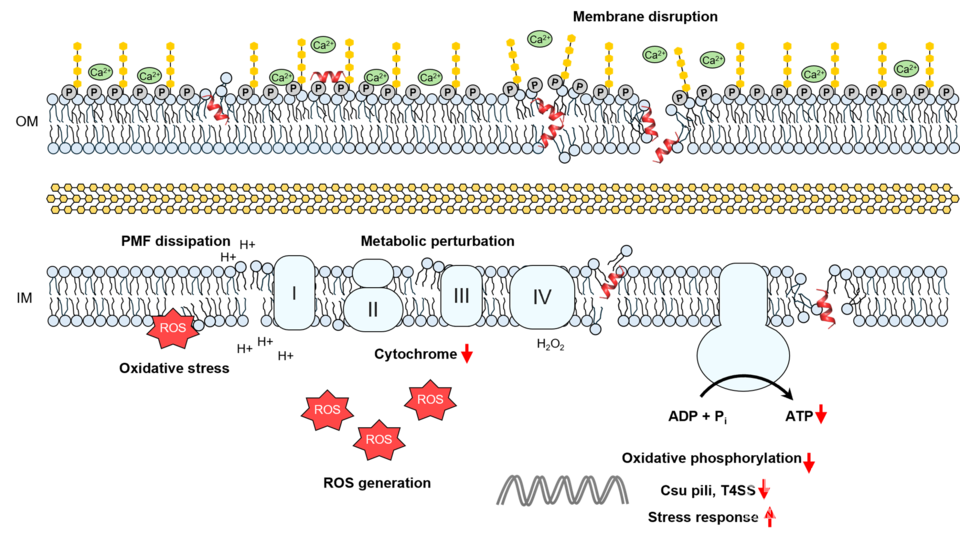
특히 이 펩타이드는 대표적인 슈퍼박테리아이자 난치성 다제내성균인 카바페넴 내성 아시네토박터 바우마니(CRAB)에 뛰어난 항균 효과를 나타냈다. 분자동력학 시뮬레이션과 핵자기공명분광법을 통해 이 펩타이드가 그람음성균의 외막과 내막을 동시에 파괴하고, 활성산소종(ROS)을 유도해 세균의 에너지 대사와 독성 인자를 억제하는 복합적 작용 원리를 확인했다. 이는 기존 항생제와는 차별화되는 방식으로, 내성 발생 가능성을 낮추는 새로운 치료 전략이라는 점에서 의미가 크다.
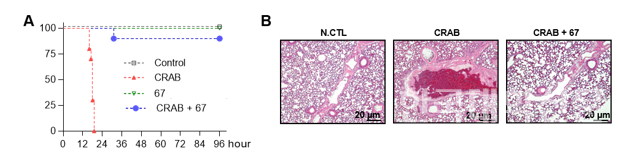
동물실험에서도 효과가 입증됐다. CRAB 감염으로 패혈증이 유도된 마우스 모델에서 펩타이드를 투여한 결과, 생존율이 크게 향상되고 장기 손상도 개선됐다. 연구팀은 현재 체내 안정성과 흡수율을 높인 후속 펩타이드 개발을 진행 중으로, 다양한 감염증 치료제로의 확장 가능성이 기대된다.
이번 성과는 단백질 구조에 착안한 항생제 개발이라는 새로운 연구 방향을 제시하며, 세계적으로 증가하는 슈퍼박테리아 감염 문제 해결에 기여할 수 있을 것으로 평가된다.
이 연구는 건국대 김양미 교수가 교신저자로, 생명공학과 석사과정 이진경·이채영 학생이 공동 주저자로 참여했으며, 과학기술정보통신부·보건복지부·국립보건연구원의 지원을 받아 수행됐다.












































































