존스홉킨스대 공동 연구, 세포 이동 원리 세계 최초 규명
암 전이, 면역 반응, 발생 과정 등 질병 연구에 새로운 단서 제공
[한국대학신문 이정환 기자] 우리 몸에 생긴 암세포가 다른 부위로 퍼지는 암 전이나, 상처를 치유하기 위해 면역세포가 이동하는 과정 등 세포의 이동은 생명현상에 꼭 필요한 과정이다. 그러나 그동안 세포가 외부 자극 없이 스스로 이동 방향을 결정하는 원리는 밝혀지지 않았다. KAIST와 국제 공동 연구진은 이번 연구를 통해 세포가 스스로 방향을 정해 움직이는 원리를 규명, 향후 암 전이와 면역 질환의 원인을 밝히고 새로운 치료 전략을 세우는 데 중요한 단서를 제시했다.

KAIST(총장 이광형)는 생명과학과 허원도 석좌교수 연구팀이 바이오및뇌공학과 조광현 석좌교수 연구팀, 미국 존스홉킨스대 이갑상 교수 연구팀과 공동으로 세포가 외부의 신호 없이도 스스로 이동 방향을 결정하는 ‘자율주행 메커니즘’을 세계 최초로 규명했다고 10일 밝혔다.
연구팀은 살아있는 세포 안에서 단백질들이 서로 어떻게 상호작용하는지를 눈으로 직접 볼 수 있는 새로운 이미징 기술 ‘INSPECT(INtracellular Separation of Protein Engineered Condensation Technique)’를 개발했다. 이 기술을 이용해 세포가 스스로 어느 방향으로 움직일지를 정하는 내부 프로그램의 원리를 밝혀냈다.
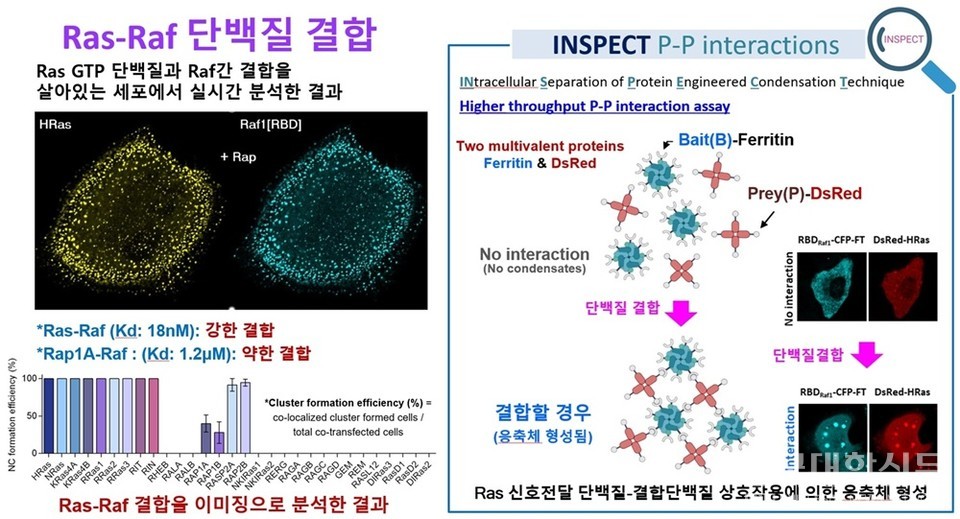
NSPECT(INtracellular Separation of Protein Engineered Condensation Technique)는 상분리(phase separation) 현상을 이용해 세포 내 단백질-단백질 상호작용을 직접 시각화하는 기술이다. 다중체 단백질인 페리틴(ferritin)과 형광단백질DsRed를 이용해 세포 내 두 단백질이 상호작용할 때 응축체(condensate)로 뭉치는 현상을 형광으로 시각화하여 보여준다.
연구팀은 세포 이동을 조절하는 핵심 단백질인 Rho 계열 단백질(Rac1, Cdc42, RhoA)의 작동 방식을 새롭게 분석했다. 그 결과, 이 단백질들이 기존에 알려진 이론인 단순히 세포의 앞뒤를 나누는 역할만 하는 것이 아니라, 어떤 단백질과 결합하느냐에 따라 세포가 직진할지, 방향을 바꿀지가 달라진다는 사실을 밝혀냈다.
INSPECT 기술은 단백질이 서로 붙을 때 서로 잘 섞이지 않고 구분된 영역이 자연스럽게 생기는‘상분리(phase separation)’현상을 인공적으로 구현하는 기술로, 세포 속에서 단백질들이 실제로 어떻게 결합하는지를 형광 신호로 직접 볼 수 있는 기술이다.
연구팀은 단백질 페리틴(ferritin)과 형광단백질 DsRed를 활용해, 단백질들이 서로 결합할 때 작은 방울처럼 뭉친 덩어리인 ‘응집체(condensate)’를 눈으로 확인할 수 있게 했다.
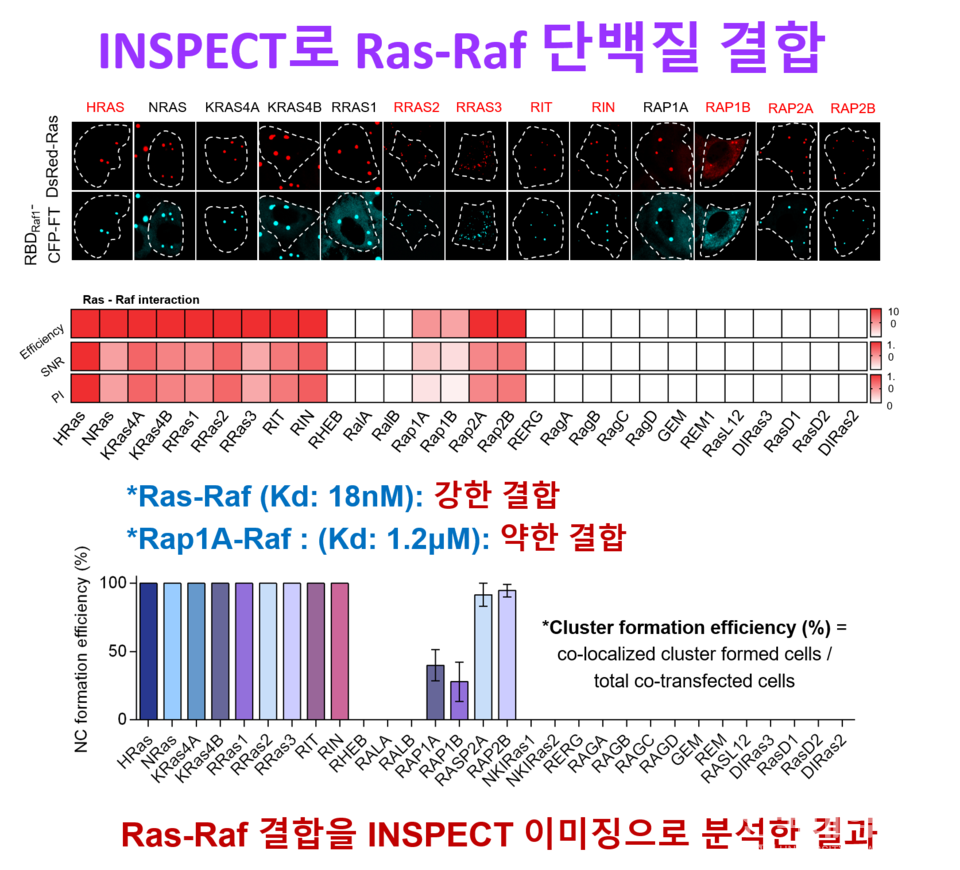
28개 Ras 패밀리를 대상으로 INSPECT로 단백질-단백질 상호작용(PPI)을 스크리닝한 결과, 문헌에 알려진 13쌍을 정확히 재현하며 오검출과 미검출 없이 신뢰성을 입증했다. 또한 응축체 형성 효율과 신호대잡음비(SNR)를 통합한 정량 지표 Protein Interaction Index(PI)를 도입해 상호작용 세기를 표준화해 비교 가능하게 했으며, 분석 결과 Rap1A/B가 다른 Ras GTPase 대비 낮은 PI를 보여 차별적 결합 강도를 정량적으로 제시했다.
이 기술로 연구팀은 15종의 Rho 단백질과 19종의 결합 단백질을 조합해 총 285쌍의 상호작용을 분석했고, 그중 139쌍에서 실제 결합이 일어남을 확인했다. 특히, Cdc42–FMNL 단백질 조합은 세포의 ‘직진’을, Rac1–ROCK 단백질 조합은 세포의 ‘방향 전환’을 담당하는 핵심 회로라는 사실을 밝혀냈다.
연구팀은 세포의 방향 조절에 중요한 단백질 Rac1의 일부(37번째 아미노산)를 살짝 바꿔서, 그 단백질이 ‘핸들 역할’을 하는 ROCK 단백질과 잘 붙지 못하게 만들었다. 그러자 세포는 방향을 바꾸지 못하고 계속 직선으로만 이동했다.
반면 정상 세포에서는 Rac1과 ROCK이 잘 결합해서 세포 앞부분에 ‘아크 스트레스 섬유(arc stress fiber)’라는 구조가 생기고, 이 섬유는 세포가 방향을 바꿀 때 직각에 가까운 방향 전환이 되도록 했다.
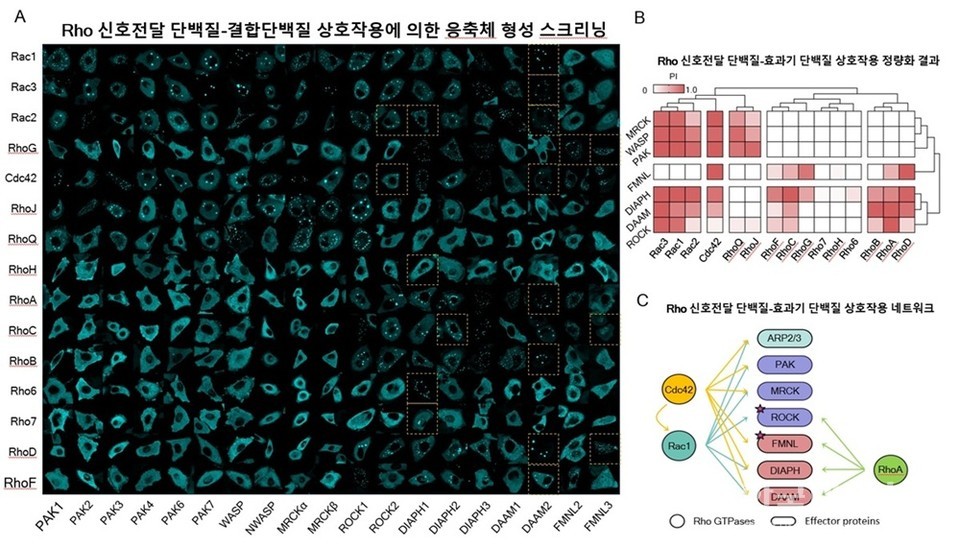
15종의 Rho 단백질과 19종의 결합 후보 단백질 간 총 285쌍의 상호작용을 스크리닝하여 139쌍의 양성 상호작용을 규명했다. 특히 Rac1–ROCK 축과Cdc42–FMNL 축이 세포 이동의‘직진’과‘회전’을 결정하는 핵심 회로임을 밝혀냈다.
또한 세포가 붙어 있는 환경을 변화시킨 실험에서, 정상 세포는 주변 환경에 따라 이동 속도가 달라졌지만, Rac1F37W 세포(핸들이 고장난 세포)는 환경 변화와 관계없이 속도는 항상 똑같았다. 이는 Rac–ROCK 단백질 축이 세포가 주변 환경을 인식하고 적응하는 능력을 세밀하게 조절한다는 것을 보여준다.
허원도 교수는 “이번 연구는 세포 이동이 무작위적인 운동이 아니라, Rho 신호전달 단백질과 세포 이동 관련 단백질의 앙상블이 만들어내는 내재적 프로그램에 의해 정밀하게 제어된다는 사실을 규명한 것”이라며, “새롭게 개발한 INSPECT 기술은 세포 내 단백질 상호작용을 시각화할 수 있는 강력한 도구로, 암 전이와 신경세포 이동 등 다양한 생명현상과 질병의 분자 메커니즘을 밝히는 데 폭넓게 활용될 것”이라고 말했다.
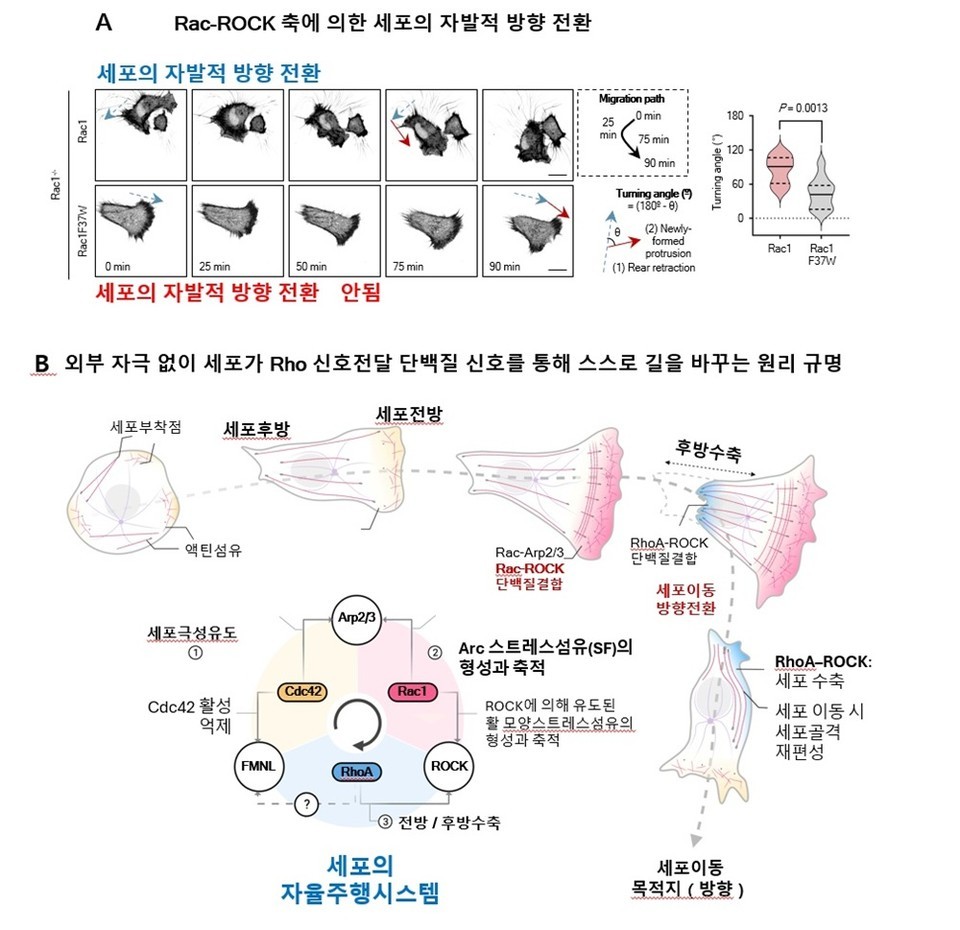
연구팀은 세포 이동을 조절하는 주요 신호전달 단백질인 Rho 신호전달 단백질 중 Rac1과Cdc42가 세포 전방에서 돌출 구조(라멜리포디아·필로포디아)를 형성하고, RhoA가 후방에서 수축을 유도한다는 기존 모델을 넘어서, 각 Rho 단백질이 어떤 결합단백질과 결합하느냐에 따라 세포 이동의 방향성과 회전 동작이 정밀하게 제어된다.
KAIST 이희영 박사, 이상규 박사(현재 기초과학연구원(IBS) 소속), 서예지 박사(현재 (주)휴룩스 소속), 김동산 박사(현재 LIBD 소속)가 공동 제1저자로 참여한 이번 연구는 네이처 커뮤니케이션즈(Nature Communications)에 논문명 ‘A Rho GTPase-effector ensemble governs cell migration behavior’ 10월 31일 게재됐다.
☞https://doi.org/10.1038/s41467-025-64635-0
이 연구는 삼성미래기술육성재단과 한국연구재단의 지원을 받아 수행됐다.












































































